自2013年癌症免疫疗法荣登《科学》年度十大科学突破之首后,这几年来以PD-1为代表的癌症免疫大热,各种临床应用层出不穷,革命性地改变的癌症冶疗的格局,获得诺奖也算是水到渠成。时隔七年,诺奖终于再度花落了免疫学领域。
癌症免疫疗法(cancer immunotherapy或immuno-oncology)是一类通过激活免疫系统来治疗癌症的方法。此类疗法采用了癌症免疫学研究的成果,这是肿瘤学中一个快速发展的研究方向。肿瘤细胞表面有能被免疫系统识别的肿瘤抗原,而这正是癌症免疫的基础。这些抗原一般为蛋白质或高分子(如碳水化合物)。免疫疗法可分为主动免疫、被动免疫与联合免疫。主动免疫疗法直接诱导自身免疫系统,使其能够识别肿瘤抗原,进而攻击肿瘤细胞。而被动免疫疗法则是借助外源物质发挥抗肿瘤作用,其中会用到单克隆抗体(简称单抗)、淋巴细胞、细胞因子等。
在这些疗法中,已有一些抗体疗法被批准用于治疗多种类型的癌症。抗体是一类由免疫系统产生的蛋白质,用于与细胞表面的靶抗原结合。免疫系统通常用其来攻击病原体。每种抗体对一种或数种蛋白质有特异性,那些能与肿瘤抗原结合的抗体可用于治疗癌症。细胞表面受体是抗体疗法的主要目标,如CD20、CD274与CD279等。一旦与肿瘤抗原相结合,抗体可以引发抗体依赖细胞介导的细胞毒(ADCC)作用、激活补体系统或阻断受体与其配体的相互作用,最终导致细胞死亡。目前已被批准的抗体包括阿仑单抗(alemtuzumab)、伊匹单抗(ipilimumab)、纳武单抗(nivolumab)、奥法木单抗(ofatumumab)与利妥昔单抗(rituximab)等。
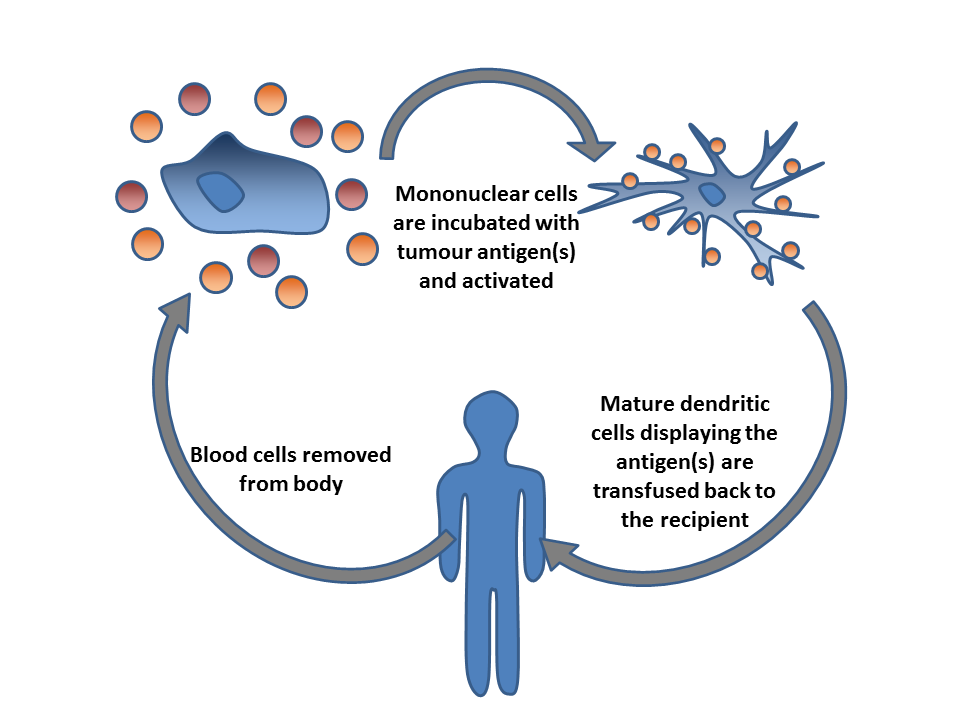
主动细胞疗法一般则会从血液或肿瘤中分离出免疫细胞,在将这些细胞体外培养后再输回患者体内去攻击肿瘤。此外,也可以经由基因工程改造后使免疫细胞表达肿瘤特异性受体,再经培养后输回患者体内。能运用于此种疗法的细胞包括自然杀伤细胞(简称NK细胞)、淋巴因子激活的杀伤细胞(简称LAK细胞)、细胞毒性T细胞(简称CTL细胞)、树突状细胞(简称DC细胞)等。
细胞免疫疗法
树突状细胞疗法
树突状细胞(DC细胞)能获取肿瘤抗原的特征信息后呈递给淋巴细胞,这些细胞在被激活后会攻击肿瘤细胞、引发抗肿瘤免疫应答。DC细胞是哺乳动物免疫系统中的一种抗原提呈细胞(APC),在癌症治疗中用于识别肿瘤抗原。Sipuleucel-T是首个经批准的基于DC细胞的癌症疗法。
一种促使DC细胞提呈肿瘤抗原信息的方法是使用自体肿瘤细胞溶解物或短肽致敏。这些抗原肽常与具有强免疫原性的佐剂一同使用,用于增强抗肿瘤免疫应答。其他佐剂还包括能吸引、激活DC细胞的蛋白质或其他化学物质,比如粒细胞-巨噬细胞集落刺激因子(GM-CSF)。
让肿瘤细胞表达GM-CSF可以在体内激活DC细胞,如运用基因工程手段改造肿瘤细胞使其产生GM-CSF,或用能表达GM-CSF的溶瘤病毒感染肿瘤细胞。
此外,亦可从患者血液中分离DC细胞后在体外将其激化。单个肿瘤特异性肽/蛋白质或者肿瘤细胞溶解物可以用来活化DC细胞。之后再将这些细胞(或加上佐剂)输回患者体内,以期引发免疫应答。
DC细胞疗法还包括使用能与DC细胞表面受体结合的抗体。将抗原加到抗体上能够诱导DC细胞成熟,进而诱发肿瘤免疫应答。TLR3、TLR7、TLR8、CD40等DC细胞受体都被用作抗体目标。
批准药物
2010年,Sipuleucel-T(商品名Provenge,普列威)被批准用于治疗无症状或仅有轻微症状的转移性去势抵抗性前列腺癌。该疗法首先采用白细胞分离术将患者血液中的抗原提呈细胞分离出来,再和由GM-CSF和前列腺酸性磷酸酶(PAP)制成的融合蛋白PA2024共同培养后输回患者体内。如此重复三次为一个完整疗程。
CAR-T细胞疗法
嵌合抗原受体T细胞(CAR-T)免疫疗法通过改造T细胞以使其能更有效地识别并杀伤肿瘤细胞。从患者体内采集T细胞后,在其中加上能够识别肿瘤细胞的嵌合抗原受体(CAR),再将融合后的CAR-T细胞输回患者体内以攻击肿瘤。批准药物
2017年,美国食品药品监督理局(FDA)批准了用于治疗急性淋巴性白血病(ALL)的CAR-T疗法tisagenlecleucel(商品名Kymriah)。该疗法能够杀死体内的CD19阳性细胞(B细胞),不过除了癌细胞外,也会杀死正常的抗体生成细胞。
Axicabtagene ciloleucel(商品名Yescarta)则是另一种CAR-T免疫疗法,于2017年被批准用于治疗弥漫大B细胞淋巴瘤。抗体疗法
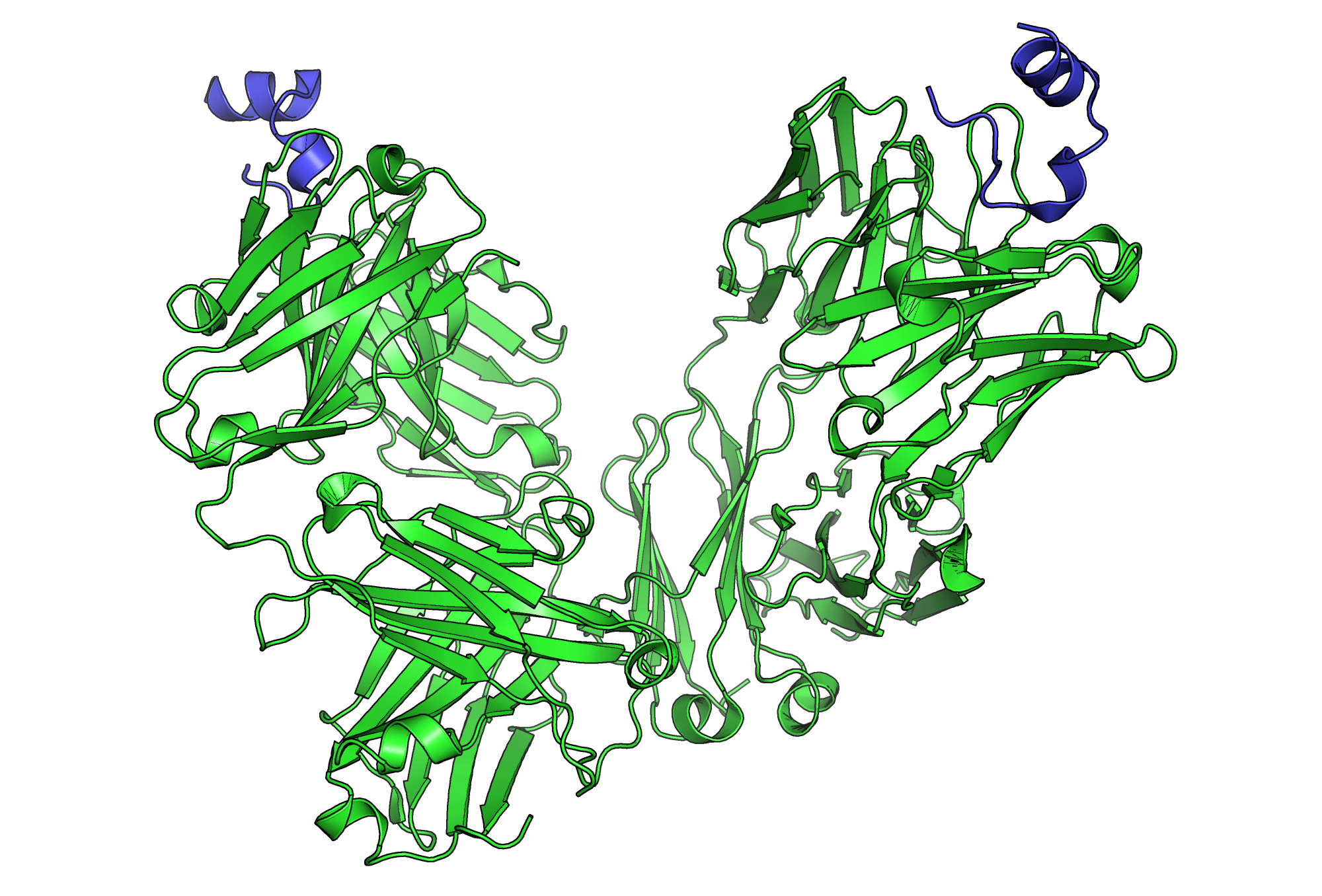
抗体是获得性免疫应答的关键,在识别外源抗原与激发免疫应答的过程中至关重要。抗体是一些由B细胞分泌的Y形蛋白质,由两个片段组成:一是用于结合抗原的抗原结合段(Fab段),二是能够与巨噬细胞、中性粒细胞、NK细胞等免疫细胞表面的Fc受体相互作用的可结晶段(Fc段)。许多免疫治疗方案到会用到抗体。应用单抗技术能够制造出针对特定肿瘤抗原的抗体。
抗体类型
偶联
运用于癌症治疗的抗体可分为两类:
- 裸单克隆抗体是指没有附加药物的抗体,大多数抗体疗法中采用的即是此类抗体。
- 偶联单克隆抗体则是将抗体与其他具有细胞毒性或放射性的分子连接在一起。用来连接的化学物质一般为化疗药物,不过有时亦会采用其他毒素。抗体与肿瘤细胞表面的特定抗原结合,从而将药物投递至肿瘤。与放射性化合物相结合的抗体称为放射性标记(radiolabelled)抗体。而同化疗药物与毒素连接的则分别被称为化疗标记(chemolabelled)抗体与免疫毒素(immunotoxin)。
Fc段
Fc段能与Fc受体结合的特征对于抗体激发免疫系统而言十分重要。Fc段有不同的亚类,并且可以经由糖基化等过程进行修饰改造。Fc段的变化会影响抗体与Fc受体结合的能力,并决定抗体所引发的免疫应答类型。包括细胞程序性死亡受体1(PD-1)抑制剂与细胞程序性死亡配体1(PD-L1)抑制剂在内的许多癌症免疫治疗药物都是抗体。比如抗PD-1的免疫检查点阻断药可以与T细胞上表达的PD-1结合,从而使激活T细胞以清除肿瘤。除了与PD-1结合的Fab段外,抗PD-1药物也有Fc段。实验表明免疫药物的Fc段能够影响疗效。例如,抗PD-1药物的Fc段如果与抑制性Fc受体结合会对疗效有负面影响。影像研究进一步表明抗PD-1药物的Fc段可能与肿瘤相关巨噬细胞表达的Fc受体结合,导致药物从其目标的T细胞上被夺去,限制了治疗效果。此外,以共刺激蛋白CD40为靶点的抗体需要与特定的Fc受体作用以达到最佳效果。这些研究说明了基于抗体的免疫检查点阻断疗法中Fc段的重要性。
非人源/人源抗体
抗体还可分为鼠源抗体、人鼠嵌合抗体、人源化抗体与人源抗体。鼠源抗体并非来自人类,因而有产生免疫反应的风险。人鼠嵌合抗体用人类抗体中的恒定区(constant region)替换鼠源抗体的对应区域,试图减轻鼠源抗体的免疫原性。人源化坑体的绝大部分都来自人类,仅有可变区(variable region)中的互补性决定区为鼠源。人源坑体则完全由人类DNA制成。
细胞死亡机制
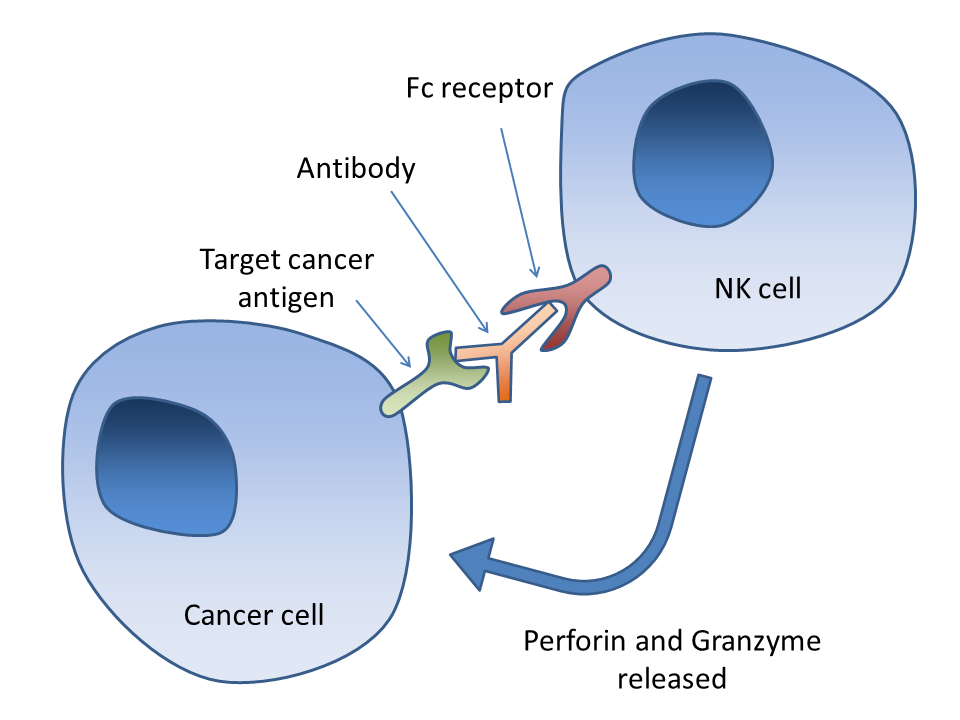
抗体依赖细胞介导的细胞毒性(ADCC)
抗体依赖细胞介导的细胞毒性(ADCC)作用需要抗体与靶细胞的表面结合。抗体由Fab段与Fc段构成,而免疫细胞可以通过其Fc受体识别抗体的Fc段。在NK细胞等许多免疫细胞中都有Fc受体。当NK细胞与被抗体覆盖的靶细胞相遇时,前者的Fc受体与后者的Fc段相互作用,进而释放穿孔素与颗粒酶B以杀伤肿瘤细胞。利妥昔单抗(rituximab)、奥法木单抗(ofatumumab)与阿仑单抗(alemtuzumab)皆采用ADCC机制。有研究试图改造抗体的Fc段,此举能提高其与一种名为FcγRIIIA的特定Fc受体的亲和力,以期显著提升疗效。
补体
当抗体与细胞表面结合、补体途径被激活后,补体系统中的血液蛋白可致使细胞死亡。这套系统平时用于清除外来病菌,但也可以被癌症治疗中的抗体所激活。无论是人鼠嵌合抗体、人源化抗体还是人源抗体都能激活该系统,只要其中包含IgG1的Fc段。补体激活杀死细胞的机制包括补体依赖的细胞毒性(形成膜攻击复合物)、增强ADCC作用以及CR3依赖细胞介导的细胞毒性。其中补体依赖的细胞毒性(CDC)在抗体与肿瘤细胞表面结合时发生,C1复合物与抗体结合后被激活,最终在肿瘤细胞膜上形成穿膜孔道。
FDA批准的抗体
| 抗体 | 英文名 | 商品名 | 类型 | 靶点 | 批准日期 | 批准疾病治疗 |
|---|---|---|---|---|---|---|
| 阿仑单抗 | Alemtuzumab | Campath | 人源化 | CD52 | 2001年 | B细胞慢性淋巴细胞白血病 |
| 阿特珠单抗 | Atezolizumab | Tecentriq | 人源化 | PD-L1 | 2016年 | 膀胱癌 |
| 阿维单抗 | Avelumab | Bavencio | 人源 | PD-L1 | 2017年 | 转移性梅克尔细胞瘤 |
| 伊匹单抗 | Ipilimumab | Yervoy | 人源 | CTLA-4 | 2011年 | 转移性黑色素瘤 |
| 奥法木单抗 | Ofatumumab | Arzerra | 人源 | CD20 | 2009年 | 顽固性慢性淋巴细胞白血病 |
| 纳武单抗 | Nivolumab | Opdivo | 人源 | PD-1 | 2014年 | 不可切除或转移性黑色素瘤、鳞状非小细胞肺癌、肾细胞癌、大肠癌、肝细胞癌、典型霍奇金氏淋巴瘤 |
| 帕姆单抗 | Pembrolizumab | Keytruda | 人源化 | PD-1 | 2014年 | 转移性黑色素瘤 |
| 利妥昔单抗 | Rituximab | Rituxan、Mabthera | 人鼠嵌合 | CD20 | 1997年 | 非霍奇金氏淋巴瘤 |
| 度伐鲁单抗 | Durvalumab | Imfinzi | 人源 | PD-L1 | 2017年 | 膀胱癌、非小细胞肺癌 |
阿仑单抗
阿仑单抗(alemtuzuma,商品名Campath-1H)是一种抗CD52的人源化IgG1单抗,用于医治氟达拉滨治疗无效的慢性淋巴细胞白血病、皮肤T细胞淋巴瘤、外周T细胞淋巴瘤与T细胞幼淋巴细胞白血病。超过95%的外周血淋巴细胞(包括T细胞和B细胞)与单核细胞表面存在CD52,但其在淋巴细胞中的作用未知。阿仑单抗能与CD52结合,经补体结合与ADCC机制引发细胞毒性作用。由于靶细胞为免疫细胞,在使用阿仑单抗治疗时可能会有感染、中毒、骨髓抑制等副作用。
阿特珠单抗
阿特珠单抗(atezolizumab,商品名Tecentriq)是一种抗PD-L1的全人源化IgG1单抗,用于治疗非小细胞肺癌、尿路上皮癌等。
度伐鲁单抗
度伐鲁单抗(durvalumab,商品名Imfinzi)是一种人源IgG1κ单抗,可阻断PD-L1和PD-1、CD80(B7.1)之间的相互作用。度伐鲁单抗被批准可用于治疗满足以下条件的局部晚期或转移性尿路上皮癌:
- 在含铂化疗期间或之后疾病有进展;
- 在含铂化疗的新辅助治疗或辅助治疗的十二个月内疾病有进展。
伊匹单抗
伊匹单抗(ipilimumab,商品名Yervoy)是一种抗细胞毒性T淋巴细胞相关抗原4(CTLA-4)的人源IgG1单抗。通常情况下,T细胞的激活依赖于两个信号:与主要组织相容性复合物(MHC)抗原结合的T细胞受体,以及与蛋白CD80或CD86结合的T细胞表面受体CD28。CTLA-4能与CD80或CD86结合,阻断它们与CD28的结合,进而抑制T细胞的活化。
免疫系统需要活化的细胞毒性T细胞去攻击黑色素瘤细胞。正常情形下被抑制的黑色素瘤特异性的活化细胞毒性T细胞可引发抗肿瘤免疫应答。伊匹单抗能够改变调节T细胞与细胞毒性T细胞的比例,以强化免疫应答。调节T细胞会抑制其他T细胞,因而更多的调节T细胞不利于清除肿瘤。
纳武单抗
纳武单抗(nivolumab,商品名Opdivo)是一种抗PD-1的人源IgG4单抗,可用于治疗不能手术或转移性黑色素瘤、某些情形下的转移性非小细胞肺癌、肾细胞癌等。
奥法木单抗
奥法木单抗(ofatumumab,商品名Arzerra)是第二代抗CD20的人源IgG1单抗。其可以与在B细胞中高表达的CD20结合,从而治疗慢性淋巴细胞白血病。奥法木单抗与CD20蛋白上的小环结合,而同样以CD20为靶点的利妥昔单抗则与CD20的大环结合。这或许可以解释两者的不同特性。与利妥昔单抗相比,奥法木单抗降低了免疫原性,在更低剂量下便能够激活CDC作用。
帕姆单抗
帕姆单抗(pembrolizumab,商品名Keytruda)是抗PD-1的人源化IgG4单抗,可用于治疗转移性非小细胞肺癌、不可切除或转移性黑色素瘤,并可在使用铂基类抗肿瘤药物后作为头颈部鳞状细胞癌的二线治疗方案,同时亦能用于治疗成人与儿童的顽固性典型霍奇金氏淋巴瘤。
利妥昔单抗
利妥昔单抗(rituximab,商品名Rituxan)是一种抗CD20的人鼠嵌合IgG1单抗,由同样以CD20为靶点的替伊莫单抗(ibritumomab)进一步研发而来,能有效治疗特定类型的B细胞恶性肿瘤,其中包括侵袭性或惰性淋巴瘤(如弥漫大B细胞淋巴瘤、滤泡淋巴瘤)以及白血病(如B细胞慢性淋巴细胞白血病)。尽管CD20的功能尚不明确,但可能与钙离子通道有关。该单抗的作用机制为补体介导的细胞毒性(CMC)。其他机制还包括细胞凋亡与细胞生长阻滞。此外,利妥昔单抗还能与化疗联用,可提高肿瘤B细胞对化疗的敏感性。
细胞因子疗法
细胞因子是肿瘤内多种细胞产生的蛋白质,可用于调节免疫应答。而肿瘤则会设法利用细胞因子以促进自身生长,降低免疫应答。细胞因子所具有免疫调节功能使它们可以作为药物被用于激发免疫应答。干扰素与白细胞介素是两类最常用的细胞因子。
白细胞介素-2(IL-2)与干扰素-α(IFNα)是能够调整、控制免疫系统行为的细胞因子。它们能增强抗肿瘤反应,因而被用于被动癌症治疗。干扰素-α被用于治疗毛细胞白血病、与艾滋病有关的卡波西氏肉瘤、滤泡淋巴瘤、慢性粒细胞性白血病与黑色素瘤。白细胞介素-2则被用于治疗黑色素瘤与肾细胞癌。
干扰素
干扰素(IFN)由免疫系统合成,一般与抗病毒应答有关,但亦可用于癌症。干扰素可分为I型(IFNα与IFNβ)、II型(IFNγ)与III型(IFNλ)三大家族。IFNα被批准用于治疗毛细胞白血病、与艾滋病有关的卡波西氏肉瘤、滤泡淋巴瘤、慢性粒细胞性白血病与黑色素瘤。I型与II型干扰素家族已被广泛研究,尽管有研究表明两者都能够提升免疫系统的抗肿瘤效果,但其中只有I型干扰素的效果经临床试验证实。IFNλ则在动物实验中表现出了抗肿瘤效应。
与I型干扰素不同,IFNγ尚未被批准用于癌症治疗。不过,已有实验表明使用了IFNγ的膀胱癌与黑色素瘤患者的生存率得到了提升。而在二期与三期卵巢癌患者中,IFNγ的效果最为明显。肿瘤细胞中IFNγ的体外实验研究则更为充分,结果表明IFNγ能有效抑制肿瘤细胞的增殖,引发细胞凋亡或自噬机制最终杀死肿瘤细胞。
白细胞介素
白细胞介素(IL)有一系列免疫调节作用。IL-2被用于治疗黑色素瘤与肾细胞癌。一般情况下IL-2能够同时激活效应T细胞与调节T细胞,对其具体的作用机理尚待研究。
联合免疫疗法
将多种免疫疗法合用(如同时使用PD-1与CTLA-4抑制剂)能够强化坑肿瘤应答,以达到持久应答的目的。
冷冻消融联合免疫疗法则能够增强免疫刺激应答并产生协同效应,可用于以根治为目的转移性癌症治疗。
在采用免疫检查点疗法的同时联用其他药物或许能加强免疫应答,这是目前临床研究的热点,如联合使用CSF-1R抑制剂与TLR激动剂就获得了良好效果。
多糖K
日本厚生劳动省于1980年代批准使用从云芝中提取的多糖K,用于激发化疗患者的免疫系统。但在美国等其他国家,多糖K属于膳食补充剂而非药物。
研究
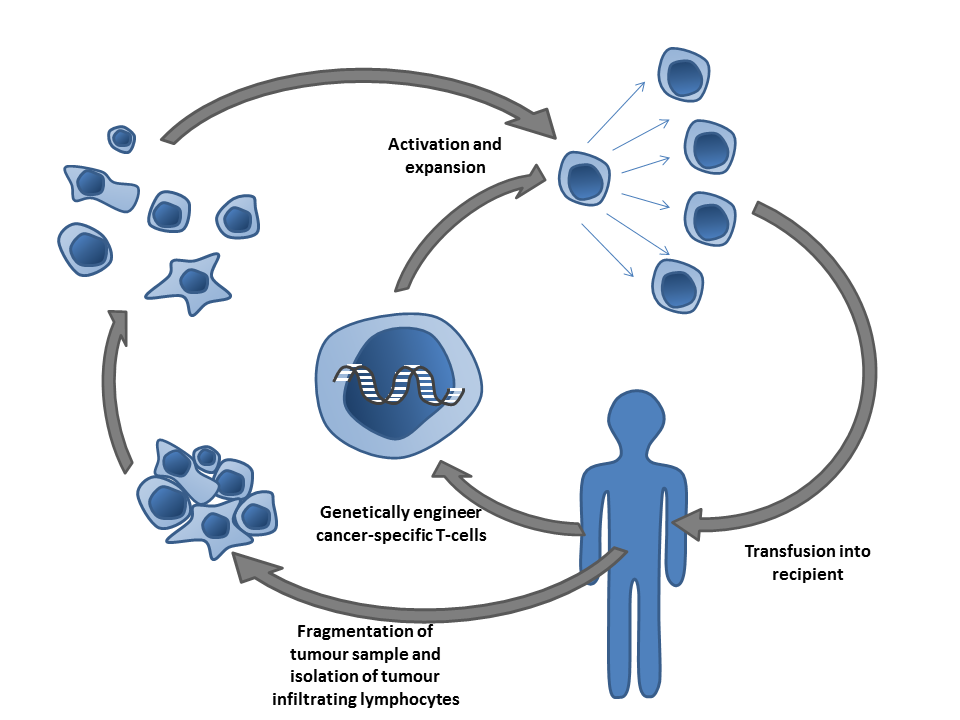
过继性T细胞疗法
过继性T细胞疗法(adoptive T-cell therapy)是一种向患者输送T细胞的被动免疫疗法。T细胞存在于血液与组织内,通常在有外源病原体时会激活。当T细胞的表面受体遇到表面抗原上呈现出外源蛋白质的细胞时,T细胞会被激活。这些细胞可以是被感染细胞或者抗原提呈细胞(APC)。T细胞同时出现在正常组织与肿瘤组织中,在肿瘤组织中的T细胞被称为肿瘤浸润淋巴细胞(TIL)。DC细胞等抗原提呈细胞将肿瘤抗原提呈给T细胞后能将T细胞激活。尽管被激活的T细胞有能力攻击肿瘤,但由于肿瘤所在的环境能够抑制免疫反应,从而防止了免疫介导的肿瘤杀伤机制。
有多种方法能够生成靶向肿瘤的T细胞。肿瘤样本或者血液中能够分离出肿瘤抗原特异性的T细胞,之后再在体外培养并激活这些T细胞,激活手段包括基因治疗或者将T细胞暴露于肿瘤抗原之中。
目前,已有多项以过继性细胞输注(ACT)为基础的临床试验。2018年发表的一项研究表明,此前多种免疫疗法治疗无效的转移性黑色素瘤患者在经ACT治疗后表现出了临床疗效。
2017年,FDA首次批准了tisagenlecleucel与axicabtagene ciloleucel两个过继性T细胞疗法。
此外,另一种方法是采用健康异体供者的半相合γδ T细胞或NK细胞进行过继性输注。此方法不会造成移植物对抗宿主疾病(GvHD),但被移植细胞的功能常会出现受损情形。
抗CD47疗法
许多肿瘤细胞上存在CD47过表达的现象,从而逃避宿主免疫系统的监视。CD47与其受体信号调节蛋白α(SIRPα)的结合,使肿瘤细胞得以逃避巨噬细胞对其的吞噬。抗CD47疗法的目的即是恢复吞噬作用。现在已有证据表明抗CD47疗法能够引发T细胞对肿瘤的特异性杀伤作用。多项以此为基础的疗法正在研发之中,其中包括抗CD47抗体、诱骗受体、抗SIRPα抗体、双特异性抗体等。截至2017年,多项针对实体肿瘤与血液系统肿瘤的临床试验已经启动。
抗GD2疗法
细胞表面的糖类抗原可以作为免疫疗法的靶点。GD2是一种神经节苷脂,存在于多种肿瘤细胞表面,包括神经母细胞瘤、视网膜母细胞瘤、黑色素瘤、小细胞肺癌、脑瘤、骨肉瘤、横纹肌肉瘤、尤文氏肉瘤、脂肪肉瘤、纤维肉瘤、平滑肌肉瘤以及其他软组织肉瘤。由于正常组织表面一般不会表达GD2,使其成为免疫疗法的一个潜在靶点。目前已有相关临床试验在进行中。
免疫检查点
免疫检查点能够影响免疫系统的功能,其可以是刺激性或抑制性的。肿瘤会利用这些检查点来保护自己、逃避免疫系统的攻击。目前经批准的免疫检查点疗法皆是通过阻断抑制性检查点受体发挥作用的。当负反馈信号被阻断后能够激起机体的免疫应答以杀伤肿瘤。
跨膜蛋白细胞程序性死亡受体1(PD-1,又称CD279)与其配体细胞程序性死亡配体1(PD-L1,又称CD274)间的相互作用是一个研究热点。肿瘤细胞表面的PD-L1能够与免疫细胞表面的PD-1相结合,以维护免疫抑制环境。PD-L1能调节T细胞功能,肿瘤通过上调PD-L1表达来抑制T细胞的活化。此外,PD-L1还能抑制依赖FAS与干扰素的细胞凋亡过程,从而保护肿瘤细胞免受由T细胞生成的细胞毒分子的杀伤。能够与PD-1或PD-L1结合的抗体可用于阻断它们的相互作用,以使T细胞发挥功能、攻击肿瘤。
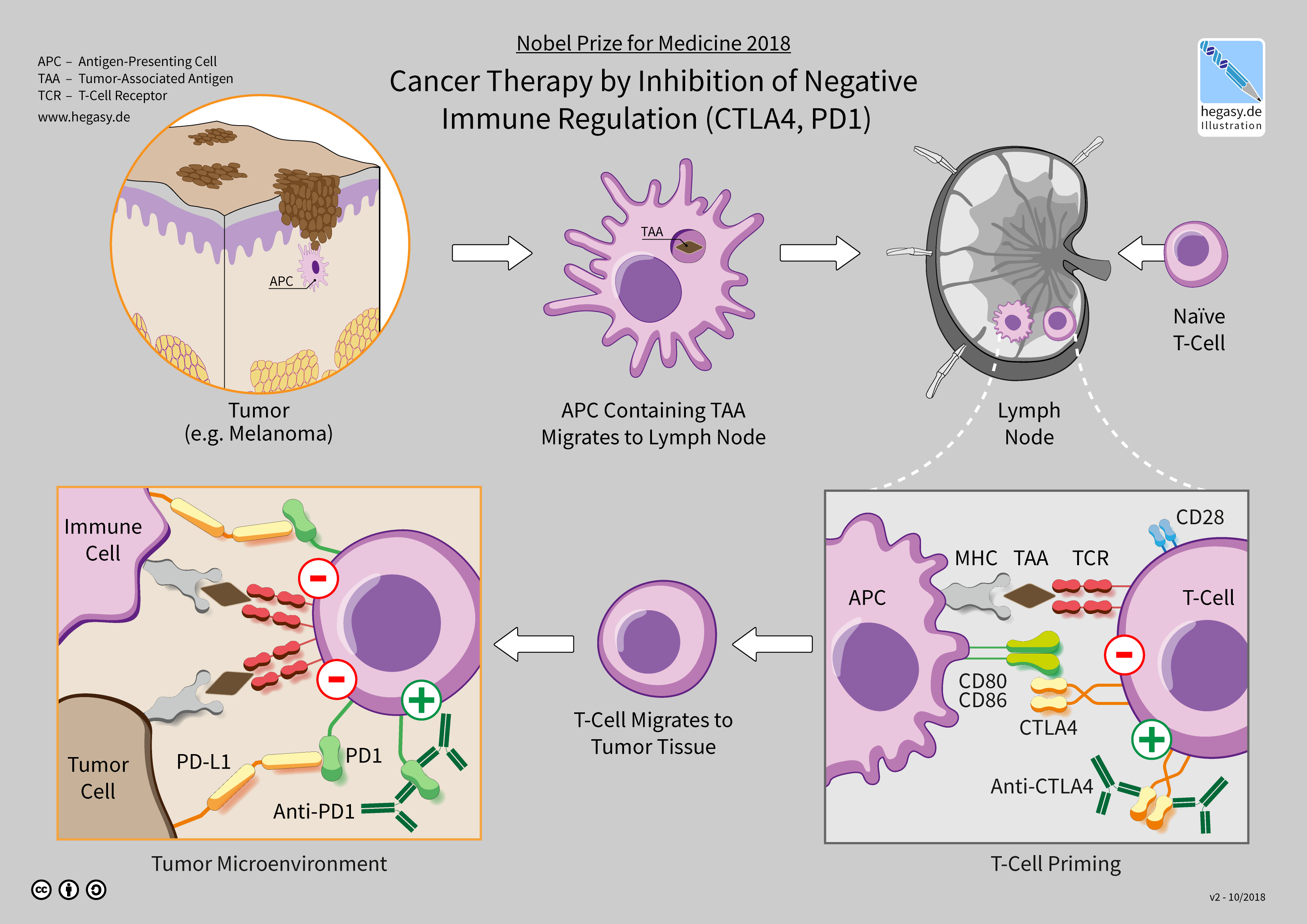
CTLA-4抑制剂
2011年,FDA批准了首个免疫检查点抗体——用于治疗黑色素瘤的伊匹单抗。伊匹单抗能够阻断检查点分子细胞毒性T淋巴细胞相关抗原4(CTLA-4)。而临床试验还表明抗CTLA-4疗法有利于肺癌与胰腺癌治疗,并能通过联合用药增强疗效。目前有试验正研究多种类型的癌症治疗中联用CTLA-4抑制剂与PD-1/PD-L1抑制剂的效果。
不过,使用检查点抗体(尤其是CTLA-4抗体)的患者常饱受免疫介导的不良反应困扰,这些副作用主要影响皮肤、胃肠道、肝脏与内分泌系统。这可能是由于注入的抗体在血液中扩散,进而在大范围内激活了T细胞。
科研人员利用小鼠膀胱癌模型研究发现,在肿瘤区域局域低剂量注入CTLA-4抗体时取得的肿瘤抑制效果与将抗体输送至全身的效果相当。由于局域输入抗体能够减少其扩散,该疗法可能有助于降低治疗的副作用。
PD-1抑制剂
抗PD-1的IgG4纳武单抗的试验结果于2010年首次发表,2014年被批准。纳武单抗可用于治疗黑色素瘤、肺癌、肾癌、膀胱癌、头颈癌、霍奇金淋巴瘤等。2016年的一项针对非小细胞肺癌的纳武单抗临床试验并没能达到一线治疗的主要终点目标,但FDA批准其可用于二、三线治疗。
帕姆单抗是另一种PD-1抑制剂,于2014年被FDA批准用于治疗黑色素瘤与肺癌。
替雷利珠单抗(tislelizumab,BGB-A317)则消除了与Fcγ受体的结合能力,目前处于早期临床试验阶段。
PD-L1抑制剂
2016年,PD-L1抑制剂阿特珠单抗被批准用于治疗膀胱癌。
目前其他正在研发中的PD-L1抗体包括阿维单抗(avelumab)、度伐鲁单抗以及一种名为Affimer的抗体替代技术。
其他
其他方法还包括以细胞内免疫检查点(如CISH)为靶点的检查点阻断疗法。还有些癌症患者经免疫检查点阻断治疗后没有缓解。与其他癌症疗法联用或许能提高检查点阻断疗法的缓解率。对癌症动物模型的研究表明,联合放疗、血管靶向药物以及免疫原性化疗(immunogenic chemotherapy)等能提升检查点阻断的疗效。
溶瘤病毒
溶瘤病毒是一类能感染并杀伤肿瘤细胞的病毒。溶瘤病毒可以特异性地在肿瘤细胞中复制、增殖,并释放出新的感染性病毒颗粒破坏其他肿瘤细胞。这种病毒不仅能直接杀死肿瘤细胞,还能刺激宿主的抗肿瘤免疫应答以利于长期免疫治疗。利用病毒来治疗癌症的想法早在20世纪初便已出现,不过直至1960年代后该领域的研究才开始逐渐系统化。腺病毒、呼肠孤病毒、麻疹病毒、单纯疱疹病毒、新城病病毒、牛痘病毒等都先后在临床试验中被用作溶瘤病毒。T-Vec则是首个经FDA批准的溶瘤病毒,可用于治疗黑色素瘤。另有其他多种溶瘤病毒正经历二期、三期临床试验。
多糖
在蕈类中发现的多糖等化合物可用于调节免疫系统,或有助于癌症治疗。例如,有实验研究发现β-葡聚糖(如香菇多糖)可激活巨噬细胞、NK细胞、T细胞及免疫系统细胞因子,已有临床试验研究其作为免疫佐剂的效果。
新生抗原
许多肿瘤细胞会出现基因突变,而这些突变可作为T细胞免疫治疗潜在的靶抗原,这些抗原就被称为「新生抗原」(neoantigen)。RNA测序数据表明,突变负荷(mutational burdern)越高的肿瘤中CD8+T细胞越多。NK细胞与T细胞的细胞杀伤活性与许多肿瘤的突变负荷呈正相关。在接受帕姆单抗治疗的非小细胞肺癌患者中,突变负荷与疗效显著相关。而在接受伊匹单抗治疗的黑色素瘤患者中,治疗的长期效果亦与突变负荷相关,尽管程度不及前例。有研究分析了经MHC呈递的新生抗原肽段后发现,治疗效果好的患者的肽段中有一组四肽序列,而在治疗无效或低效的患者中却没有。不过其他一些研究中的新生抗原却没有表现出四肽特征。